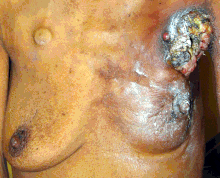
سرطان البروستات

موقع البروستات معلومات عامة الاختصاص علم الأورام
من أنواع أمراض البروستاتا الموقع التشريحي بروستاتا
الإدارة
أدوية
إيثينيل إيستراديول، وفيناستيريد، وميتوكسانترون، وإيتوبوسيد، ونيلوتاميد، وبيكالوتاميد، وثنائي إيثيل ستيلبوستيرول، وسيسبلاتين، وإستراديول، وليوبرورلين، وإيستراميوستين/وهيدروكسي يوريا، وأمينوغلوتيثيميد، وسيبروتيرون أسيتات، وحمض زوليدرونيك، وكاربازيتاكسيل
، ونيلوتاميد

سرطان الموثة أو سرطان البروستاتا هو شكل من أشكال السرطان الذي يتطور في البروستاتة،
يمكن للخلايا السرطانية التي تنتشر من البروستاتة إلى أجزاء أخرى من الجسم، خصوصًا العظام والعقد الليمفاوية. يمكن أن يسبب سرطان البروستاتة الألم، صعوبة في التبول، مشاكل أثناء الاتصال الجنسي أو ضعف الانتصاب. يمكن للأعراض الأخرى أن تتطور خلال المراحل المتقدمة للمرض.
== تختلف نسبة اكتشاف المرض حول العالم، حيث أنها أقل في جنوب وشرق آسيا عنها في أوروبا وأمريكا تحديدًا. يعتبر سرطان البروستاتة أكثر شيوعًا لدى الرجال الذين تجاوزوا سن الخمسين. عالميًا، يعتبر سرطان البروستاتة سادس نوع من أنواع السرطانات المسببة للوفاة (الثاني في الولايات المتحدة الأمريكية). سرطان البروستاتا أكثر شيوعًا في البلدان المتقدمة بينما تتزايد نسبته في البلدان النامية.
العديد من المصابين بسرطان البروستاتا لا تظهر لديهم الأعراض أو لا يحصلون على علاج معيّن وقد يتوفون لأسباب غير متعلقة بالمرض في نهاية الأمر. العوامل المؤثرة على تطور المرض تشمل العوامل الوراثية والطبيعة الغذائية وغيرها.
يمكن اكتشاف سرطان البروستاتا بالتعرف على الأعراض المصاحبة، الفحص الإكلينكي ( السريري ) , اختبار نسبة المستضد الخاص "الانتيجين" في الدم specific antigen-prostate (PSA) أو عن طريق الخزعة (أخذ عينة من النسيج). اختبار المستضد الخاص بالبروستاتا يساعد على فرص اكتشاف السرطان ولكنه لا يقلل من نسبة الوفاة. أوصت هيئة الخدمات الوقائية الأمريكية United States Preventive Services Task Force عام 2012 ضد استخدام اختبار المستضد الخاص "الانتيجين" PSA test وذلك بسبب مخاوف في الإفراط في التشخيص والعلاج مع كون معظم حالات سرطان البروستاتة بدون أعراض. معتبرة أن الفائدة المتوقعة من ذلك الاختبار لا تفوق المخاطر المحتملة.الاستراتيجيات المتبعة للسيطرة على المرض ينبغي أن توجّه تبعًا لحدة المرض. الأورام المنخفضة الخطورة يمكن أن تخضع للمتابعة الدورية والمستمرة من قبل الطبيب. العلاج يتضمن : الجراحة والعلاج الإشعاعي وفي الحالات الأكثر تقدمًا يمكن استخدام طرق مثل العلاج بالتبريد أو التجميد cryosurgery، العلاج الهرموني والعلاج الكيميائي (في بعض الحالات يعطى المريض العلاج الهرموني مصاحبًا للعلاج الإشعاعي). بعض الدراسات تقترح أن ممارسة العادة السرية تقلل من خطر الإصابة بسرطان البروستاتا
من العوامل المهمة المحددة لنتيجة العلاج عمر المريض وحالته الصحية العامة، مدى الانتشار السرطاني، شكل الأنسجة المصابة تحت المجهر ومدى الاستجابة للعلاج الأولي. اتخاذ القرار المناسب سواء المباشرة في علاج سرطان البروستاتا (المحصور في الغدة فقط ) من عدمه هو نوع من المقايضة يجريها المريض بين الفوائد المتوقعة والأضرار المحتملة، من ناحية نجاة المريض ونوعية الحياة التي سوف يحياها.
-----------------------
الأعراض
عادةً لا يسبب سرطان البروستات أي أعراض في مراحله الأولى. وفي بعض الأحيان تشبه أعراض سرطان البروستات أعراض الأمراض الحميدة كضخامة البروستات الحميدة. هذه الأعراض تشمل كثرة التبول، كثرة التبول أثناء الليل، وصعوبة في بداية التبول وصعوبة في الحفاظ على تدفق مستمر من البول، بول دموي (دم في البول) أو تبول مؤلم.
تقريباً حوالي ثلث المرضى الذين شُخصوا بسرطان البروستاتا لديهم على الأقل واحد أو أكثر من هذه الأعراض، بينما الباقون ليس لديهم أي أعراض.
ويرتبط سرطان البروستاتا عادةً باختلال في وظيفة التبول، وذلك لأن غدة البروستاتا تحيط بقناة مجرى البول من جميع الجهات. وبالتالي أي تغييرات في الغدة تؤثر بشكل مباشر على وظيفة التبول .
ولأن "الوعاء الناقل " يفرز السائل المنوي في قناة مجرى البول في البروستاتا ولأن إفرازات غدة البروستاتا نفسها تشكل نسبة من محتوى السائل المنوي، قد يسبب سرطان البروستاتا أيضاً بمشاكل في الوظيفة الجنسية والأداء الجنسي مثل صعوبة الانتصاب أو آلام عند القذف.يمكن لسرطان البروستاتا في مراحله المتقدمة أن ينتشر إلى أجزاء أخرى من الجسم، مما يسبب أعراض إضافية . وأكثر الأعراض شيوعا هي آلام العظام، وغالباً في الفقرات (عظام العمود الفقري) ، الحوض، أو الأضلاع . ومن الممكن أن ينتشر أيضاً في العظام الأخرى مثل عظم الفخذ "عادة الجزء القريب من العظام". كما يمكن لسرطان البروستاتا المنتشر في العمود الفقري أن يسبب ضغطاً في الحبل الشوكي أيضا، مما يؤدي إلى أعراض كضعف بالساق وسلس البول أو البراز .
الأسبابحتى هذه اللحظة أسباب سرطان البروستاتا لا تزال غير واضحة ولا يوجد تفسير كامل لها. عوامل الخطر الأساسية هي السمنة والعمر والتاريخ العائلي، سرطان البروستاتا غير شائع في الرجال الذين تقل أعمارهم عن 45 عاما، ولكنه يصبح أكثر شيوعا مع التقدم في السن . متوسط أعمار المصابين بسرطان البروستاتة عند التشخيص هو 70 سنة.ومع ذلك، كثير من الرجال لا يعرفون أن لديهم سرطان البروستاتا، فقد وجدت الدراسات التي أُقيمت على عيّنه مأخوذة من جثث رجال من مختلف الجنسيات "الصينية والألمانية، جامايكا، السويدية، والأوغندية" الذين ماتو بأسباب أخرى لا علاقة لها بسرطان البروستاتا، أن نسبة 30% من الرجال في الخمسينات ونسبة 80% من الرجال في السبعينات كان لديهم سرطان البروستاتا دون علمهم.يتضاعف خطر الإصابة بسرطان البروستاتا عند الرجال الذين لديهم أفراد الأسرة من الدرجة الأولى مصابين بهذا السرطان مقارنة بالرجال الذين ليس لديهم أقرباء مصابين بسرطان البروستاتا في الأسرة.و هذا الخطر يبدو أكبر عند الرجال الذي لديهم أشقاء مصابين مقارنة بالرجال الذين لديهم آباء مصابين بهذا السرطان . في الولايات المتحدة في عام 2005، كان هناك ما يقدر ب 230,000 حالة جديدة من سرطان البروستاتا و 30,000 حالة وفاة بسبب سرطان البروستاتا. الرجال المصابين بارتفاع ضغط الدم هم أكثر عرضة لسرطان البروستاتا. وهناك ارتفاع صغير في نسبة خطورة الإصابة بسرطان البروستاتا ترتبط بعدم ممارسة الرياضة. الدراسات التي أجريت خلال عام 2010 وجدت أن المنشأ الأكثر شيوعا لسرطان البروستاتة هو الخلايا القاعدية.
الجيناتكما أشارت المنظمات فقد تساهم الخلفية الوراثية في خطر الإصابة بسرطان البروستات لارتباطه بالعرق والعائلة وجينات خاصة منوعة . ويحتمل إصابة الرجل الذي له قريب مصاب من الدرجة الأولى (أب أو أخ) بسرطان البروستاتا بمرتين، ويرتفع خطر إصابة أولئك الذين لديهم أقارب مصابين بالدرجة الأولى (2) إلى خمسة أضعاف مقارنة مع الرجال الذين لا يوجد لديهم إصابات في تاريخهم العائلي.ويؤثر سرطان البروستات في الولايات المتحدة على الرجال أصحاب البشرة السوداء أكثر من تأثيرة على أصحاب البشرة البيضاء أو اللون الحنطي.في المقابل، تعتبر نسبة معدل الإصابة والوفيات للرجال البيض الثلث بالنسبة لأصحاب البشرة الحنطية، وأشارت الدراسات التي جرت على التوأم في إسكندنافيا ( Scandinavia) أن معدل خطر الإصابة الوراثي يمثل 40%.لا يوجد جين محدد يسبب الإصابة بسرطان البروستات : قد تسببه جينات كثيرة، ويكون التغيير في BRCA1 و BRCA2 له تأثير كبير للإصابة بسرطان المبيض والثدي لدى النساء والبروستاتة عند الرجال.هناك جينات أخرى لها علاقة مثل سرطان البروستات الجيني ومُستقبِل منشط الذكورة ومُستقبِل الفيتامين د ويساعد انقسام خلية TMPRSS2 وخصوصاً TMPRSS2-ERG أو TMPRSS2-ETV1\4 على نمو خلايا سرطانية.يعود فقدان الجينات الكابتة للسرطان في وقت مبكر من تسرطن البروستات إلى الصبغيات 8P,10Q,13Q,16Q .
وتم كذلك ملاحظة فقدان التكرار النسبي لجين E-cadherin و CD44 .
التغذيةهناك بعض العوامل الغذائية التي قد رُبطت بسرطان البروستات في حين أن الأدلة ما زالت غير مؤكدة لذلك. لكن بعض الأدلة أثبتت، بأن هناك أنواع من الأغذية من الفواكه والخضراوات، تلعب دوراً ضئيلاً حيث تعتبر من العوامل المسببة لسرطان البروستات. أيضا وحسب بعض الدراسات الإنسانية، أن أنواع اللحوم الحمراء والمصنعة قد تؤثر قليلاً على البروستات. كما أن بعض الدراسات أثبتت، بأن استهلاك كمية كبيرة من اللحوم له ارتباط بارتفاع خطر الإصابة بسرطان البروستات. و أن النقص في فيتامين د، يزيد من خطر الإصابة به أيضا. بالإضافة إلى تناول بعض من الفيتامينات المتنوعة أكثر من سبع مرات في الأسبوع، قد يزيد من خطر الإصابة بالمرضقالب:Npsn. ولقد أظهرت دراسة في عام 2009، أن تناول المكملات الغذائية: مثل حمض الفوليك يزيد من خطر الإصابة بالمرض
قالب:Npsn.
التعرض للعلاجاتيوجد هناك بعض الروابط بين سرطان البروستات وتعاطي أنواع من العلاجات، والخضوع للعمليات الطبية، وبعض من الحالات الطبية. وأن استخدام بعض العقاقير المخفضة للكوليسترول المعروفة باسم استاتين، قد تساعد في تقليل خطر الإصابة بالمرض.و أن بعض الإصابات أو التهابات البروستات قد تساهم في زيادة فرص الإصابة بالمرض، بينما أثبتت دراسات أخرى أن بعض الإصابات قد تحد منه وذلك عبر تحفيز جريان الدم في المنطقة. وبالتحديد، الإصابة بالأمراض التي تنتقل عن طريق الاتصال الجنسي مثل: الكلاميديا والسيلان، والزهري، التي تزيد من خطر الإصابة. أخيرًا السمنة وارتفاع مستويات التيستوستيرون في الدم قد يزيد من خطر الإصابة أيضا. كما أن هناك علاقة بين استئصال الأسهر وسرطان البروستات، ولكن هناك حاجة لمزيد من البحوث لتحديد ما إذا كانت هذه العلاقة سببية. مثل البحوث التي نُشرت في مايو/أيار من العام 2007 ووجدتْ أن المحاربين الأمريكيين القدامى الذين تعرضوا لمادة العامل البرتقالي في حرب فييتنام، قد زادت نسبة الخطورة في إصابتهم بالمرض مرةً أخرى بعد العملية الجراحية بما يعادل 48 ٪.
العدوى الفيروسيةفي عام 2006، ربط بعض الباحثين "فيروس إكس إم آر في" - والذي لم يكن معروفاً حتى ذلك الوقت - بأورام البروستات. وكانت التقارير اللاحقة بشأن الفيروس متناقضة. فقد وجدت مجموعةٌ أخرى من الباحثين الأمريكان هذا الفيروس في أورام البروستات، بينما أكّد علماء ألمان أنهم لم يجدوه في عينات من الأورام نفسها. وفي دراسةٍ أخرى في وقت لاحق (شارك فيها عدد من باحثي دراسة عام 2006)، توصّل الباحثون إلى إن الاكتشاف المعلن في عام 2006 ربَّما كان نتيجة وجود تلوث في الأورام لا بسببها هي نفسها، ومن ثم فإن الفيروس لا علاقة له بالمرض.
العوامل الجنسيةأظهرت العديد من الدراسات، أن تعدد الشركاء الجنسيين أو البدء في العلاقة الجنسية مبكراً تزيد من الإصابة بسرطان البروستاتا. حيث تظهر الدراسات وجود أمراضٍ منتقلة جنسياً مسببة لسرطان البروستاتا في بعض الحالات، وفي أبحاثٍ كثيرةٍ لم يتم تحديد رابط واضح بين الأمراض الجنسية وظهورها قبل أم بعد تشخيص سرطان البروستات، وأظهرت دراسات عن الأمراض المنتقلة جنسياً وذلك قبل عقد من تشخيص سرطان البروستات وجود رابطٍ بين أنواع عديدة من هذه الأمراض،(HPV-16, HPV-18 and HSV-2).). ويمكن تفسير مثل هذا الأمر بوجود مرض منتقل جنسياً غير معروفٍ بعد، وبأن أعراض سرطان البروستات لا تبدأ بالظهور إلا بعد الإصابة بهذا المرض بوقتٍ طويل.
الميكانيكية (الآلية) المرضية

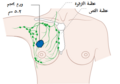
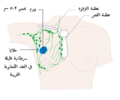
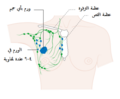
توضح الصورة أعلاه موقع البروستات والأعضاء القريبة منه , الإحليل والمثانة والمستقيم.
البروستات هي جزء من أجزاء الجهاز التناسلي الذكري، والتي تساعد في تكوين وتخزين السائل المنوي عند الذكر البالغ. تكون البروستات بطول 3 سم تقريباً وتزن ما يقارب 20 غراماً. تقع البروستات في منطقة الحوض تحت المثانة وأمام القناة الشرجية. تحيط القناة بجزءٍ من الإحليل، وهو الأنبوب الذي ينقل البول من المثانة أثناء عملية التبول، ويحمل السائل المنوي أثناء عميلة القذف، وبسبب موقعها هذا فإن أمراض البروستات تؤثر على عملية التبول والقذف وفي حالاتٍ نادرةٍ على عملية التغوط. تحتوي البروستات على العديد من الغدد الصغيرة والتي تساهم في تكوين 20% من السائل الموجود في السائل المنوي الذكري.
في سرطان البروستات، تتحول خلايا البروستات الغددية إلى خلايا سرطانية. تحتاج الغدد البروستاتية للهرمونات الذكرية المعروفة بالأندروجينات للعمل بشكل صحيح، والأندروجينات تتكون من التستوستيرون (بالإنجليزية: Testosterone) الذي يُصنَع في الخصيتين، والديهايدروابندروستيرون (بالإنجليزية: dehydroepiandrosteron) الذي يُصنَع من الغدد الكظرية، والديهايدروتيستوستيرون (بالإنجليزية: dihydrotestosterone) والذي يتحول من التستوستيرون (Testosterone) في البروستات نفسها. وأما الأندروجينات فهي مسؤلة عن الصفات الجنسية الثانوية، كظهور شعر الوجه وزيادة الكتلة العضلية للجسم.
يُصنَّف سرطان البروستات بين السرطانات الغددية (بالإنجليزية: adenocarcinoma)، والتي تحدث نتيجة تحول خلايا الغدد الطبيعية المفرزة للسائل المنويّ إلى خلايا سرطانية. المنطقة التي تحتوي الغدد الإفرازية في البروستات - والتي تتحول إلى خلايا سرطانية - تقع في المنطقة الطرفية (الخارجية) من البروستات. في البداية تكون الكتل السرطانية محدودة ومعزولة عن الغدد البروستاتية، وهذه الحالة تُسمَّى السرطان المغلف (بالإنجليزية: carcinoma in situ) أو الأورام البروستاتية داخل الطهارة (بالإنجليزية: prostatic intraepithelial neoplasia). ومع ذلك لا يوجد دليلٌ يُثبِت أن هذه الأورام البروستاتية "داخل الطهارة" هي خلايا سرطانية، إلا إنها مرتبطة بشكل وثيقٍ بالسرطان. مع مرور الوقت تبدأ هذه الخلايا السرطانية بالتكاثر والانتشار للأنسجة البروستاتية المحيطة بها، وفي نهاية المطاف سينمو هذا الورم بشكل كافٍ لاختراق الأعضاء المحيطة به، كالحويصلات المنوية أو القناة الشرجية. أو أن تكون هذه الخلايا السرطانية ذات قدرةٍ على الانتقال عبر الأوعية الدموية أو الجهاز اللمفاوي. يعتبر سرطان البروستات من السرطانات الخبيثة، لأن خلاياه تستطيع زراعة نفسها في الأجزاء الأخرى من الجسم. وهذا ما يُسمَّى بالانتشار، وسرطان البروستات ينتشر بشكلٍ أكبر في العظام و الغدد اللمفاوية، ومن الممكن أن ينتشر إلى القناة الشرجية والمثانة والجزء السفلي من الحالب. ويعتقد أن طريقة انتشاره في العظم تعتمد على الأوردة كالشبكة الوريدية للبروستات، والتي تَصبُّ في الأوردة الفقرية.البروستات هو عضو يقوم بتجميع الزنك وإنتاج السترات. البروتين "ZIP1" هو المسؤول عن نقل الزنك إلى داخل خلايا البروستات، ومن أهم أدوار الزنك في الخلية هو تغيير عملية الأيض في الخلايا لإنتاج السترات، الذي يعتبر من المكوّنات الأساسية للسائل المنوي. إن عملية تخزين الزنك وتغيير مستوى الأيض وإنتاج السترات عملية مستهلكة للطاقة، فخلايا البروستات تستهلك كميَّاتٍ كبيرةً من الطاقة (بالإنجليزية: ATP) حتى تقوم بتلك المهام. تكون الخلايا السرطانية في البروستات عادة خالية من الزنك، ممَّا يًمَكِّنها من توفير الطاقة، حيث أنها لا تقوم بإنتاج السترات وبذلك تستفيد من الطاقة المتوفرة في النموّ والانتشار. يعتقد أن سبب انعدام الزنك في الخلايا المسرطنة في البروستات هو توقف عمل المورث المسؤول عن إنتاج البروتين الناقل "ZIP1"، لذلك فإن البروتين "ZIP1" يعتبر منتجاً جينياً مانعاً للأورام، وهو ناتج عن المورث "SLC39A1". سبب حدوث الخلل اللاجيني الذي يجعل خلايا البروستات تتوقف عن إنتاج البروتين الناقل "ZIP1" غير معروف. جُرِّبت طرق عدّة لنقل الزنك إلى داخل الخلايا المسرطنة في الحيوانات للتخلص منها، فعند إدخال الزنك يقوم بوقف عمل المسار الكيميائي للبروتين "NF-κB"، وبالتالي يمنع انقسام وتزايد الخلايا المصابة، ويُحَفِّز موتها. إلا إنَّ تناول كميَّاتٍ من الزنك عن طريق الفم غير مفيد لعلاج مثل هذه الحالات، وذلك لعدم وجود البروتين الناقل "ZIP1". يمنع عامل النسخ الجيني "RUNX2" حدوث الموت الطبيعي للخلايا السرطانية، ممَّا يُحفّز تكاثرها وانتشار سرطان البروستات. ويعمل مؤشر التتالي "PI3k/Akt" مع موشر التتالي لعامل النمو "beta/SMAD" حتى يضمن حماية الخلايا السرطانية من الموت الطبيعي.يُعتَقد أن المورث "XIAP" والذي يمنع موت الخلايا طبيعياً، يدعم بقاء وتزايد الخلايا السرطانية في البروستات، وهو هدف للباحثين في هذا المجال/ حيث إنَّ معرفة كيفية تعطيل عمل هذا المورث ستعيد عملية الموت الطبيعي للخلايا إلى العمل، وبالتالي ستُوقف تزايد الخلايا السرطانية. يقوم المورث "MIC-1" بتحفيز مسار عمل البروتين "FAK" ممَّا يؤدي إلى نموّ وتكاثر الخلايا السرطانية في البروستات.تساعد مستقبلات الأندروجين خلايا سرطان البروستات على البقاء على قيد الحياة، وهو محطّ اهتمام كثيرٍ من الباحثين في مجال دراسة وعلاج السرطان. حتى الآن، لم ينجح كبح عمل هذه المستقبلات إلا في الأبحاث التي أُجريت على الفئران.يُحفّز العامل المضاد الخاص بالبروستات "PSMA" نموّ وتطور سرطان البروستات، حيث إنه يرفع مستويات الفوليت الذي تتعذى عليه الخلايا السرطانية. ويرفع هذا العامل المضاد مستوى الفوليت عن طريق الحليل المائي للقلوتاميتيد فولايت.
التشخيصإن موقف الجمعية الأمريكية للسرطان فيما يتعلق بالكشف المبكّر هو: «لم يُثبِت البحث حتى الآن أن الفوائد المحتملة المرجوة من الفحص، تفوق الأضرار التي يسببها الفحص والعلاج. إن الجمعية تؤمن بأن الرجال يجب ألا يخضعوا للفحص بدون أن يعلموا عمَّا نعرفه وعمَّا لا نعرفه من المخاطر والفوائد المحتملة للفحص والعلاج، تحدث إلى طبيبك حول سلبيات وإيجابيات الفحص، بدءاً من سن الـ50 (أو 45 في حال كنت أمريكياً من أصل أفريقي، أو لديك أخ أو أب أصيب بالحالة قبل سن الـ65)، لتستطيع اتخاذ القرار عما إذا كان الفحص هو الخيار المناسب لك.
»
إن الفحص الوحيد الذي يؤكد بشكل كامل التشخيص بالإصابة بسرطان البروستات، هو أخذ الخزعة (بالإنجليزية: biopsy), و هو إجراء يتم فيه إزالة قطع صغيرة من البروستات للفحص المجهري. و على أية حال، من الممكن إجراء فحوصات أقل عدوانية قبل إجراء الخزعة.
ووفقاً للبروفيسور هاردي باندا، رئيس مشروع البروستات وأستاذ علم المسالك البولية في كلية الدراسات العليا الطبية بجامعة سري، أن فحصاً أقلَّ عدوانية يبحث في وجود البروتين إنجرايلد-2 أو "Engrailed-2" (EN2) في عينة البول، من شأنه أن يكون أكثر موثوقيَّة ودقَّة من الفحوصات التي تُجرَى حالياً.
«أظهرنا في هذه الدراسة، أن الفحص الجديد كان أفضل بمرتين في اكتشاف سرطان البروستات من الفحص القياسي بي إس إيه (بالإنجليزية: Standard PSA). حيث إنه ندر وجود بروتين الإن2 (EN2) في عيّنات بول الرجال غير المصابين بالسرطان، لذلك إذا وجد البروتين إن2، نستطيع أن نكون متأكدين من أن الرجل مصاب بسرطان البروستات، وفي ذات الوقت فإن هذا البروتين لم يكتشف عند الرجال الذين يعانون من خللٍ في البروستات – غير السرطان - مثل الالتهاب أو الأورام الحميدة. كثيراً ما تسبّب هذه الحالات ارتفاعاً في نتيجة فحص البي إس إيه، مما يسبب توتراً للمريض، وفي بعض الأحيان يتسبب بإجراء المزيد من الفحوصات غير الضرورية مثل خزعات البروستات.
»
هناك أيضاً عدة فحوصات أخرى يمكن أن تستخدم لجمع معلومات أكثر حول البروستات والمسالك البولية. فهناك مثلاً الفحص الإصبعي للمستقيم (بالإنجليزية: DRE)، الذي قد يسمح للطبيب باكتشاف أي شذوذٍ يطرأ على البروستات. وأيضاً فحص تنظير المثانة، الذي يعرض للطبيب المسالك البولية من داخل المثانة، وذلك باستخدام أنبوب رفيع مرن موصل بكاميرا يتم إدخاله إلى الإحليل. أما التصوير بالموجات الصوتية عبر المستقيم فيستخدم لتكوين صورةٍ للبروستات باستخدام الموجبات الصوتية الصادرة من مسبار يدخل في المستقيم.
تصوير البروستاتالموجات فوق الصوتيةوالرنين المغناطيسي هما وسيلتا التصوير المستخدمتان للكشف عن سرطان البروستات. يستخدم أطباء المستقيموالمسالك البولية الموجات فوق الصوتية للحصول على خزعة، ولكن مجال الرؤية فيها يكون أحياناً ناقص الصدى. كما أن الموجات فوق الصوتية لديها رؤية نسيجية ضعيفة، لذلك لا تستخدم سريرياً في الغالب. في المقابل، يتميَّز تصوير البروستات بالرنين المغناطيسي بالنسيج الرقيق العلوي. التصوير بالرنين المغناطيسي هو نوع من أنواع التصوير، يعتمد على المجالات المغناطيسية لتحديد وتمييز مكان سرطان البروستات، وتوجد منه أربعة أنواع هي: "تصوير T2 الموزون"، "وتصوير T2 الموزون"، و"التصوير الانتشاري الموزون"، و"تصوير الرنين المغناطيسي الطيفي"، و"تصوير التباين الديناميكي المعزز". ويستخدم الأخصائيون أشعة الرنين المغناطيسي للتعرف على سرطان البروستات. وفي الغالب تستخدم وحدها لتحديد المنطقة الأفضل لأخذ الخزعة منها، وقد تستخدم - بالإضافة إليها - الموجات فوق الصوتية. وفي دراسة أجريت على عدد من الرجال المرشحين وجد الباحثون أن الرنين المغناطيسي اكتشف 33% من السرطانات، مقارنة بـ7% اكتشفت عن طريق الأشعة فوق الصوتية. كما أنه يساعد في التخطيط الجراحي الذي يجرى للمرضى قبل عملية استئصال البروستات، إذ يمكنه تحسين تحديد طريقة إجراء الجراحة، فإمَّا يقوم الجراح باستئصال الحزم الوعائية العصبية، أو يُقرّر علاج حصر البول ومن ثم إعادة تقييم صعوبة الجراحة. تعتقد بعض جماعات التوعية بسرطان البروستات أنه ينبغي استخدام الرنين المغناطيسي للكشف عن السرطان، كما هو الحال في الماموغرام ودوره في كشف سرطان الثدي. وتقوم الدراسات السريرية التي يجريها معهد الصحة الوطنية الأمريكية حالياً بدراسة تكاليف استخدام الرنين المغناطيسي في مثل هذه التطبيقات.
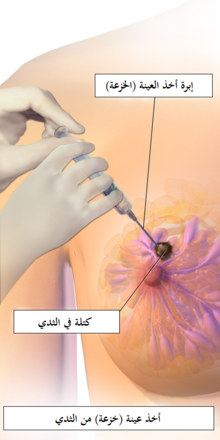
الخزعة
 مقالة مفصلة: خزعة البروستات
مقالة مفصلة: خزعة البروستاتإذا اشتُبِه بوجود سرطان البروستات عند أحد المرضى، يتم أخذ خزعة على وجه السرعة. حيث يقوم أخصائي المسالك البولية أو أخصائي الأشعة بأخذ عينة من أنسجة البروستات عن طريق المستقيم، فيتم إدخال المنظار وتستعمل إبرة مجوفة لإزالة ما يقدر بثلاثة إلى ستة إنشات من كل جانبٍ في البروستات في أقل من ثانية، وعادة يتم القيام بها كإجراء روتيني في العيادات الخارجية، إذ لا يتطلب هذا دخولاً أو تنويماً في المستشفى. وقد أوردت التقارير أنَّ ما نسبته خمسة وخمسون في المئة من الرجال يشعرون بعدم الراحة أثناء إجرائها.
مقياس (نقاط) جليسون

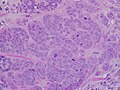
صورة مجهرية تظهر سرطان البروستاتا
 مقالة مفصلة: مقياس جليسون
مقالة مفصلة: مقياس جليسونيتم فحص عيّنات الأنسجة المأخوذة عن طريقة الخزعة بالمجهر للبحث عن الخلايا السرطانية وتقييم خواصّها المجهرية، التي يطلق عليها مقياس (نقاط) جليسون. مولد المضاد الغشائي للبروستات (PSA) هو عبارة عن إنزيم يُسمَّى الكاربوكسي بيبتيداز (بالإنجليزية: Carboxypeptidase) مسؤول عن تنشيط إنزيم فوليت هيدرولاز (بالإنجليزية: (Folate hydrolase). ويتمثل هذا البروتين في الأنسجة السرطانية في البروستات، وبالتالي يرتفع معدل نقاط جليسون.
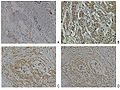
علامات الأوراميتم صبغ عيّنات الأنسجة للكشف عن وجود مولّد المضاد الغشائي للبروستات (PSA) وعلامات الأورام الأخرى، من أجل تحديد منشأ الخلايا الخبيثة المنتشرة.يعتبر سرطان الخلايا الصغيرة أحد أنواع سرطان البروستات النادرة، ويشكل نسبة 1% من معدل الإصابات بالسرطان، ولا يمكن اكتشافه بفحص مولد المضاد الغشائي للبروستات (PSA) المستعمل عادةً. اعتباراً من عام 2009 بدأ الباحثون في البحث عن أفضل طريقة للكشف عن هذا النوع من سرطان البروستات، نظراً إلى قلَّة المعلومات عنه وعن مدى خطورته الشديدة وانتشاره السريع إلى كافَّة أجزاء الجسم. من الطرق الممكنة للكشف عنه طريقة الفصل الكروماتوغرافي بمطياف الكتلة، أو فصل البروتينات عن طريق أجهزة الكشف عن الأجسام المضادة أو الأجسام المناعية. يعتمد هذا الاختبار على قياس كميَّة إحدى علامات الأورام المسماة "مثبط البروتين سي" (بالإنجليزية: Protein C inhibitor) مع استخدام نقاط جليسون. لا تكمن ميزة هذا الاختبار في سرعته فقط، ولكن بحساسيّته وقدرته للكشف عن مرضى المنطقة الرمادية من التشخيص الذين يخلو مصلهم من مولدات المضاد الغشائية الخاصة بسرطان البروستات، ونسبتهم تعادل 10-20% من إجماليّ مرضى هذا السرطان.يرتبط وجود الأونكوبروتين (Oncoprotein) لخلايا بي الليمفاوية 2 (B-cell lymphoma2) مع تطور الأندروجين المستقلّ لسرطان البروستات، وذلك بسبب سرعة تمثيل الأندروجينات المستقلة للأورام في المراحل المتقدمة من المرض. عادة ما ينتج عن إزالة الأندروجين من خطوط خلايا سرطان البروستات في فئران التجارب المخصية تمثيل خلايا بي الليمفاوية 2، ويشير هذا إلى وجود علاقةٍ بينها وبين تطور سرطان البروستات. وقد يكون اختبار وجود بروتين "Ki-67" بالطرق المناعية النسيجية الكيميائية (بالإنجليزية: Immunohistochemistry) مؤشراً هامَّاً في التأكد من نتائج إصابة المريض بسرطان البروستات.الإي آر كي 5 (ERK5) هو عبارة عن بروتين آخر يمكن استخدامه كعلامةٍ من علامات الورم، حيث يوجد بمعدَّلاتٍ عاليةٍ في حالة سرطان البروستات، بما في ذلك السرطان الشرس الذي ينتشر في بقية أجزاء الجسم. كما يتواجد أيضاً في الحالات التي يتراجع فيها السرطان نتيجة العلاج عن طريق الهرمونات. وقد وجد الباحثون أن نقص معدل الإي آر كي5 في الخلايا السرطانية يُقلّل من قدرتها على الانتشار.
التصنيف
 مقالة مفصلة: تصنيف سرطان البروستاتة
مقالة مفصلة: تصنيف سرطان البروستاتةيعتبر تقييم سرطان البروستات أو تحديد مرحلته أو مدى انتشاره، جزءاً مهماً من تقييم السرطان، ومعرفة المرحلة يساعد على تحديد التشخيص ويُفِيد أثناء اختيار العلاجات المناسبة.
النظام الأكثر شيوعاً لعملية التصنيف هو نظام المراحل الأربعة تي إن إم، المختصر من الحروف الإنجليزية الأولى لكلمة ورم وعقد ونقائل، ويعتمد هذا النظام على قياس حجم الورم، وإحصاء عدد الغدد اللمفاوية المعنية، ووجود النقائل الأخرى.
الميزة الأهم التي يوفّرها نظام التصنيف هي ما إذا كان السرطان مقتصراً على البروستات أم لا. ففي نظام التي إن إم ذو الأربع مراحل، يظهر أن سرطانات تي 1 وتي 2 للسرطان توجد في البروستات فقط، بينما سرطانات تي 3 وتي 4 تنتشر في أماكن أخرى من الجسم.
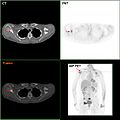
وهناك عدة اختبارات يمكن استخدامها للكشف عن انتشار السرطان في الجسم، وتوصي المنظمات المهنية التخصصية الطبية بعدم استخدام المسح المقطعي البوزيتروني (PET SCAN) أو المسح المقطعي المحوسب (CT SCAN) أو مسح العظام أثناء تصنيف الطبيب لمرحلة مبكّرة من سرطان البروستات يحتمل وجود ورم خبيث فيها.
سوف تكون هذه الاختبارات مناسبةً في بعض الحالات، مثل التي يُقيّم فيها المسح المقطعي المحوسب انتشار السرطان في الحوض، أو يحدد فيها مسح العظم انتشاره إلى العظام، أو فحص الرنين المغناطيسي عن طريق المستقيم وتقييمه للكبسولة البروستاتية و الحويصلات المنوية. فمسح العظم يجب أن يكشف عن ظهور خلايا عظمية نتيجةً لازدياد كثافة العظام في مناطق تواجد النقائل العظمية، وهذا على عكس العديد من السرطانات الأخرى ذات النقائل.
بعد إجراء خزعة البروستات، يفحص اختصاصي علم الأمراض العينات المأخوذة تحت المجهر، فإذا ما لوحظ وجود ورم سرطاني يُقرّر المختص درجة الورم. وهذه الدرجة تُبيّن مدى اختلاف أنسجة الورم عن أنسجة البروستات الطبيعية، وتضع تصوُّراً لسرعة نموّه. ويستخدم نظام جليسون لتقييم درجات أورام البروستات على مقياسٍ من 2 إلى 10، حيث الدرجة 10 في هذا النظام تشير إلى الحالة الأكثر اختلالاً. ثم يُعيّن اختصاصي علم الأمراض رقما من 1 إلى 5 للنمط الأكثر شيوعاً الذي لوحظ تحت المجهر، ويكرر ذلك على النمط الثاني الأكثر شيوعاً. ومجموع هذين الرَّقمين هو درجة غليسون. وهنالك طريقة أخرى تستخدم في بعض الأحيان تسمى نظام إيتمور-جيويت (بالإنجليزية: Whitmore-Jewett stage).
الوقايةهناك علاقة معتبرة بين أسلوب الحياة (شاملاً النظام الغذائي) والوقاية من السرطان. في ضوء النظرة إلى الدهون المشبعة، من المحتمل أنَّ لها علاقة بزيادة مخاطر الإصابة. فيما أن الأحماض الدهنيةوأوميغا 3 ليست لها أي مخاطر أو تأثير على السرطان. ربَّما يخفض تناول الأسماك من معدل الموت بسبب سرطان البروستات، إلا إنَّ تأثيره على الإصابة بالسرطان من الأساس غير واضح. وتدعم بعض الأدلة أن الوجبات النباتية الخالية من اللحوم تُخفّض من معدل الإصابة بسرطان البروستات.
النظام الغذائي
من المستحسن أن يحافظ الناس على نظام غذائي يحد من استهلاك الأطعمة والمشروبات السكرية الكثيفة، واللحوم الحمراء والمصنعة، والكحول، بينما يزيد من تناول الطعام النباتي. تؤيّد بعض الأدلة اتّباع نظام غذائي نباتي أو حمية نباتية. وقد تساهم الدهون المتحولة في زيادة خطر الإصابة بالسرطان، ولكن الأدلة ما زالت محدودة.
قد يقلل القذف على نحو أكثر تواتراً أيضاً من خطر إصابة الرجل بسرطان البروستات. أظهرت إحدى الدراسات أن الرجل الذي يقذف بين 3-5 مرات في الأسبوع في سن 15-19 سنة، سيقلّ معدل إصابته بسرطان البروستات عندما يصبح في سن متقدم، وذلك على الرغم من أن بعض الدراسات الأخرى أظهرت - على العكس - عدم وجود فائدة أو أثرٍ للقذف على الإصابة بالمرض. وتظلُّ الأدلة على هذه الظاهرة ضعيفة. المعلومات التي تربط التغذية بسرطان البروستاتا ضعيفة. في ضوء هذا يرتبط معدل الإصابة بسرطان البروستاتا باتباع النظام الغذائي الغربي. وهناك أدلة قليلة تدعم وجود ارتباط بين الدهون المشبعة وغير المشبعة وكذلك تناول الكربوهيدرات وخطر الإصابة بسرطان البروستاتا. الأدلة بشأن دور أحماض أوميغا 3 الدهنية في الوقاية من سرطان البروستاتا لا تشير إلى أنها تقلل من خطر الإصابة به، إلا أن هناك حاجة لبحوث إضافية. ويبدو أن مكملات الفيتامينات ليس لها تأثير على السرطان، ولكن بعضها قد يسبب زيادة خطر الإصابة به، وتناول كميات كبيرة من الكالسيوم يرتبط بسرطان البروستاتا المتقدم. ربما يخفض تناول الأسماك من معدل الوفيات الناتجة عن سرطان البروستاتا ولكن لا يظهر له أي تأثير على إمكانية الإصابة بالسرطان. وبعض الأدلة تدعم وجود معدلات منخفضة من سرطان البروستاتا مع اتباع النظام الغذائي النباتي.(91) هناك بعض الأدلة الأولية للأطعمة التي تحتوي على الليكوبينوالسيلينيوم. النظام الغذائي الغني بالخضروات، والصويا، والفول والبقوليات الأخرى يرتبط مع خطر أقل للإصابة بسرطان البروستاتا خاصة السرطانات المتقدمة.
الرجال الذين يمارسون الرياضة بانتظام قد يقل لديهم خطر الإصابة بشكل طفيف. خاصة التمارين الحركية النشيطة، تقلل خطر السرطانات المتقدمة خصوصا.
الأدويةبالنسبة للأشخاص الذين يجرون دورياً فحص "5-alpha-reductase inhibitor" بكلا نوعيه، فإنَّ خطر الإصابة بسرطان البروستات يون أقلّ, لكن على أية حال، لا توجد بعد معلومات كافية للحكم بما إذا كان لهذا أثر على خطر الموت لدى مرضى السرطان.
هناك علاجان يقومان بمنع تحول هرمون التوستيرون إلى ديهادروتوستيرون وهما الفيناستيرايدو (finasteride) والدوتاستيرايد (dutasteride)، وقد أظهرت هذه الأدوية بعض النتائج الواعدة. لا يزال استخدام هذه العلاجات في الوقاية من سرطان البروستات قيد البحث، وهي لا تستخدم بكثرة بعد لهذا الغرض. أظهرت دراسة في عام 2008 أن استخدام الفيناستيرايد قلَّل من احتمال الإصابة بسرطان البروستات بنسبة 30%، بدون أي خطر من الإصابة بسرطان البروستات من الدرجة العالية. في الدراسة الأساسية، اتَّضح أن حجم البروستات المصغر الناتج عن عقار الفيناستيرايد معناه أن هناك إمكانية أكبر لأن يتمكن الأطباء من تحديد مكان التجمع السرطاني وإيجاد الخلايا التي تبدو عنيفة. من الممكن أيضاً لتناول مثبطات الاختزال 5 -ألفا (5-alpha-reductase inhibitors-ARIs) أن يقلل من نسب الإصابة بسرطان البروستات من حوالي 5-9% إلى حوالي 4-6% خلال 7 سنوات من العلاج.
الفحوصاتفحوصات سرطان البروستات هي عبارةٌ عن محاولاتٍ لإيجاد سرطانات غير متصورة أو متوقعة، وقد تؤدي إلى فحوصات أخرى مترتبة عليها مثل الخزعة، حيث تؤخذ عينة من الخلايا لتحليلها ودراستها. تتضمَّن الوسائل المتاحة الفحص الشرجي الرقمي (DRE) بالإضافة إلى فحص الدم الجيني الخاص بالبروستات (PSA). لا زالت هذه الفحوصات مثيرة للجدل، وقد تؤدي عند البعض إلى أعراض مؤلمة وخطرةٍ في بعض الأحيان. الفحوصات الروتينية التي تستعمل أيّ من هاتين الطريقتين ليست مؤيدة بأي أدلة علمية، حيث أنه لا يوجد تأثير إيجابي لها لخفض معدل الوفيات جرَّاء الإصابة بالمرض.لا تنصح القوات الأمريكية الخاصة للخدمات الوقائية (USPSTF) بفحص البي إس إيه لتشخيص سرطان البروستات للرجال الأصحَّاء، بغضّ النظر عن العمر، وقد استنتجت أن المنافع المرجوَّة من الفحوصات لا تفوق المخاطر المحتملة: «لم يثبت أن الفحوصات الجينية الخاصة بسرطان البروستات أدت لتقليل نسبة الوفيات من المرض، كما أن لهذه الفحوصات آثاراً جانبية مؤذية مرتبطة بالعلاج قد تكون غير ضرورية». وقد أيَّد مراكز مكافحة الأمراض واتقائها هذه النتائج. اقترحت الجمعية الأمريكية لعلم الأورام السريري (ASCO) عدم الحثّ على إجراء الفحوصات لمن يُتوقَّع أن يعيشوا عشر سنواتٍ أو أقل، في حين إذا كان من المتوقع أن يعيش الشخص لمدَّةٍ أطول فيجب أن يتم اتخاذ القرار عن طريق مناقشة الشخص المعنيّ بطرح الميزات والمساوئ للفحص والعلاج. وعموما، وبالاعتماد على الأبحاث السابقة تم استنتاج أنه: " غير مؤكد ما إذا كانت المنافع المرجوة من فحص الأنتيجين الخاص بالبروستاتا للكشف عن سرطان البروستاتا تستحق الأضرار الناتجة أو المترتبة على هذا الفحص والتي يترتب عليها علاجات غير ضرورية. ودعت الجمعية الأمريكية للمسالك البولية إلى الموازنة بين منافع منع الوفاة من سرطان البروستاتا في رجل من كل 1000 رجل يخضع للفحص في فترة زمنية تتجاوز عشر سنوات وبين الأضرار المترتبة على الفحص والعلاج. وأوصت هذه الجمعية أيضا باتخاذ قرار الفحص للأشخاص الذين في العمر من 55 إلى 69 سنة مع مشاركة هؤلاء الأشخاص في اتخاذ هذا القرار. وفي حال تم إجراء هذه الفحوصات يجب ألا تُجرى أكثر من مرة كل سنتين.
علاج سرطان البروستاتأول قرار يتخذ لعلاج سرطان البروستاتا هو تحديد إذا ما يحتاج المريض إلى علاج أصلاً. حيث أن سرطان البروستاتا - خاصة النوع الشائع منه - من الأشكال منخفضة الدرجة ويشخص به المرضى كبار السن ويتطور غالبا ببطء ولا يتطلب علاجا ، ويموت الشخص من أسباب أخرى. وقد يكون العلاج غير مناسب أو غير ممكن إذا كان لدى المريض مشاكل صحية خطيرة تمنع العلاج أو لا يتوقع أن يعيش مدة كافية لظهور الأعراض. في هؤلاء الأشخاص يقوم الأطباء بما يسمى المراقبة التوقعية أو الفاعلة
، حيث يتم متابعة المريض بشكل دوري، والتدخل فقط عندما يبرز أدلة تدل على تطور المرض.
ويعتمد تحديد الخيار الأفضل بين العلاج أم المراقبة الفاعلة على مرحلة المرض و مقياس جليسون و مستوى المستضد البروستاتي النوعي PSA. كما يعتبر السن والصحة العامة وتصوّر المريض للعلاج المحتمل وآثاره الجانبية من العوامل المهمة أيضاً في قرار العلاج. ولأن كل العلاجات لها آثار جانبية كبيرة مثل عدم القدرة على الانتصابوسلس البول؛ خاصةً سلس الإجهاد، تركز المشاورات بشأن العلاج على تحقيق التوازن بين أهداف العلاج ومخاطر تغيير نمط الحياة.
ويستطيع المريض أيضا تعبئة استبيان الثمانية عشر بندا الموضوع حديثا لمعرفة ما إذا كان لديه معرفة جيدة وفهمه خيارات العلاج قبل اختيار أحدها. و لكن معظم المرضى المشخصين حديثا الذين اختاروا فعلا أحد الخيارات العلاجية لم يتمكنوا من الإجابة بشكل صحيح على أكثر من نصف الأسئلة.الغالبية العظمى من الحالات لا زالت تشخص للرجال الأكبر من 65 عام، وتقريباً 25% من الحالات هي للرجال الأكبر من 75 عام. توجيهات الشبكة الوطنية العامة لسرطان البروستات في الولايات المتحدة أوصت باستخدام متوسط العمر المتوقع أكبر من وأقل من 10 سنوات للمساعدة في اتخاذ قرارات المعالجة؛ عملياً فإن العديد من المرضى الأكبر سناً لم تعرض لهم خيارات علاج شفائية مثل الاستئصال الجذري لغدة البروستاتا (RP) أو المعالجية بالإشعاع ويتم التعامل بدلاً من ذلك بالعلاج الهروموني أو الانتظار اليقظ (المراقبة الفاعلة). كما أن متوسط العمر المتوقع يزيد بسبب التطورات في معالجة القلب الأوعية الدموية والمعالجة الرئوية وأمراض أخرى مزمنة. وعلى الأرجح أن أكثر المرضى من كبار السن سوف يعيشون حياة طويلة كافية ليتحملوا الآثار من مرضهم بسرطان البروستات؛ بسبب ذلك يوجد حالياً الكثير من الاهتمام بوسائل علاج انتشار سرطان البروستات مثل الجراحة أو بالإشعاع لكبار السن الذي لديهم مرض متمركز. عندما يكون السرطان مقتصر على غدة البروستات (غير منتشر لأجزاء أخرى من الجسم) فإنه من غير المعروف ما إذا كان استئصال البروستاتا أفضل أو أسوأ من الانتظار اليقظ.
المراقبة الفاعلةالعديد من الرجال والذين تم تشخيصهم باحتمالية قليلة لإصابتهم بسرطان البروستات يجب مراقبتهم بشكل فاعل. وهذا المصطلح معناه الملاحظة الدقيقة للورم مع مرور الوقت، بنية المعالجة في حال ظهور أي ورم سرطاني. المراقبة الفاعلة تعني مراقبة الورم لأي علامة لنموه أو ظهور الأعراض. قد تحتوي عملية الترصد على تسلسل فحوصات المستضد البروستاتي النوعي PSA، أو فحص بدني للبروستاتا، أو فحص النسيج الجسدي بشكل دوري عند الطبيب. الهدف من الترصد النشط هو تجنب العلاج الزائد، وأحياناً تجنب للأعراض الجانبية المزمنة والجدية لعلاج ورم لا يشكل خطورة على المريض في حالات أن الورم بطيء النمو، أو محدود النمو ذاتياً. هذا النهج لا يستخدم للسرطانات العدوانية، وقد يسبب خوف وقلق للمرضى اللذين يعتقدون أن كل السرطانات قاتلة، أو أن ورمهم بهدد حياتهم. بالنسبة لـ 50% إلى 75% المصابين بسرطان البروستاتا، لا يشكل السرطان أي أذى للرجل، المراقبة الفاعلة أو الترصد النشط قد يكون أجدى الخيارات.
بسبب فحص المستضد البروستاتي النوعي (PSA)، حوالي 90% من المرضى يتم تشخيص حالاتهم باكراً، حيث يتمركز السرطان في غدة البروستاتا ولا ينتشر، ويتم استئصال البروستات بواسطة عملية جراحية أو بالمعالجة بالإشعاع، وتؤول معظم الحالات إلى النجاح والشفاء. لذلك، حوالي 94% من المرضى الأمريكيين يرغبون بالمعالجة، ومع ذلك 50-70% من هؤلاء المرضى لم ولن يؤثر السرطان على حياتهم حتى لو ظلوا بدون معالجة؛ وبموافقتهم على العلاجهم يجازفون بحياتهم الجنسية ووظائفهم البولية والعوارض الجانبية الأخرى للعلاج . فعلى سبيل المثال، ثلثي المرضى المعالجين لا يستطيعون الحصول على انتصاب كاف للعضو الذكري خلال العملية الجنسية؛ والثلث الآخر أغلبهم لديهم مشاكل في التسرب البولي.
العلاجيوجد الكثير من الخيارات العلاجية الجراحية وغير الجراحية لسرطان البروستات، ولكن قد يكون العلاج صعباً، ويتطلب استخدام أكثر من طريقة سوياً. علاج سرطان البروستاتا يقتضي الجراحة (عملية استئصال البروستات)، والعلاج الإشعاعي الموضعي (prostate brachytherapy)، و العلاج الإشعاعي الخارجي المتذبذب، وموجات الصوتية عالية الكثافة (HIFU)، والعلاج الكيميائي، و مخدرات العلاج الكيميائي الفمي (Temozolomide/TMZ)، والتجميد، والعلاج الهرموني، أو تجميع بعض العلاجات.العلاجات المتاحة للمرضى الذين لا يزال السرطان ضمن البروستات " غير منتشر" بشكل عام هي هي الانتظار مع المراقبة الحذرة / المراقبة النشطة، العلاج الإشعاعي بالإشعاع الخارجي، العلاج الإشعاعي الموضعي، التجميد، HIFU، والجراحة. وغالبا ما يتم التحفظ على العلاج الهرمونيوالعلاج الكيميائي للمرضى الذين انتشر السرطان فيهم لخارج البروستات. ومع ذلك، هناك استثناءات: يمكن استخدام العلاج الإشعاعي لبعض الأورام المتقدمة، كما يمكن أن يستخدم العلاج الهرموني لبعض الأورام في مرحلة مبكرة. ويمكن أيضا العلاج بالتبريد (عملية تجميد الورم)، ويمكن أن يقدم للمريض العلاج الهرموني، والعلاج الكيميائي إذا فشل العلاج المبدئي وكان السرطان في تقدم. تم اكتشاف لقاح يدعى "sipuleucel-T"، وجد أنه يحقق فائدة.حينما يجري العلاج الإشعاعي أولا ويفشل؛ فإن عملية استئصال البروستات تعتبر عملية صعبة فنيا وربما تكون غير ممكنة. ومن الناحية الأخرى، فإن القيام بالعلاج الإشعاعي بعد عملية استئصال فاشلة يحتمل مضاعفات عديدة.
العلاج غير الجراحي
يتضمن العلاج غير الجراحي العلاج الإشعاعي الموضعي (prostate brachytherapy)، والعلاج الإشعاعي الخارجي المتذبذب، والموجات الصوتية عالية الكثافة (HIFU)، والعلاج الكيميائي، والعلاج الكيميائي الفمي (Temozolomide/TMZ)، والتجميد، والعلاج الهرموني، وقد يحتوي أكثر من واحد من هؤلاء. معظم أنواع السرطان المعتمدة على العلاج بالهرمونات تسترجع نشاطها خلال فترة 1-3 سنوات على الرغم من الاستمرار في عملية العلاج. يطلق على هذا النوع مسمى السرطان المقاوم للإخصاء (CRPC) وذلك لعدم استجابته للعلاج الإخصائي (الحد من انتاج هرمون الأندروجين، التستسترون، DHT وذلك عن طريق الطرق الكيميائية أو الجراحية) فهذا النوع من السرطان ما زال يظهر نوع من الاعتماد على الهرمونات لتنشيط مستقبلات الأندروجين. ومع ذلك، هنالك اليوم العديد من العقارات المتوفرة لعلاج هذا النوع من السرطان والتي تساعد على إطالة مدة البقاء.
تم استخدام عقار الدوسيتاكسل (docetaxel) كعلاج كيميائي لسرطان البروستات المقاوم للإخصاء والذي يساعد على البقاء بمتوسط 2-3 أشهر وقد كان أول عقار ينال ترخيص منظمة الغذاء والدواء الأمريكية في عام 2004 والذي ثبت إطالته لمدة البقاء على قيد الحياة. وفي عام 2010 وافقت منظمة الغذاء والدواء الأمريكية أيضا على خط ثاني للعلاج الكيميائي يسمى كابازيتاكسل وبغض النظر عن استخدام عقار الكيتوكونازول (ketoconazole) عن طريق الفم لعلاج أمراض الفطريات فهو يستخدم أحيانا كوسيلة للتلاعب بالهرمونات ذات الأثر العلاجي لسرطان البروستات المقاوم للإخصاء ولكن يظل له بعض الآثار الجانبية ولذلك يفضل أن يستخدم عقار أبيراتيرون (abiraterone) كبديل له نظرا لتميزه بنفس خاصية العمل مع آثار جانبية أقل سمية. وبإستخدام مزيج من كل من بيفاسيزوماب (bevacizumab) والمعروف تجاريا باسم أفاستين (Avastin) مع دوسيتاكسل (docetaxel) و ثاليدومايد (thalidomide) و بريدنيزون(prednisone) يبدو أنه فعال في علاج سرطان البروستات المقاوم للإخصاء وكذلك العلاج بـ سيبيلوكال تي sipuleucel-T ويطيل معدل البقاء على قيد الحياة بمتوسط 4-1 أشهر. الخط الثاني في العلاج الهرموني (abiraterone) (Zytiga) أكمل مرحلته التجريبية الثالثة المرضى الذين لديهم سرطان بروستات مقاوم للخصي وفشلوا في العلاج الكيميائي في عام 2010. وكانت النتائج إيجابية مع ارتفاع معدل النجاة بالإجمال بنسبة 4.6 أشهر مقارنة مع الدواء الوهمي. في 28 أبريل 2011، صدقت منظمة الغذاء والدواء الأمريكية على استخدام (acetate abiraterone) مع تركيبة مع بريدنيزون لعلاج المرضى الذين يعانون من المرحلة المتأخرة (المنتشر) ولديهم سرطان البروستاتا المقاوم للخصي والذين تلقوا علاج (docetaxel) "علاج الكيميائي" من قبل. (Enzalutamide) هو علاج آخر من الخط الثاني في العلاجات الهرمونية صدق عليه في أغسطس 2012 من قبل إدارة الأغذية والعقاقير في الولايات المتحدة. أظهرت نتائج المرحلة التجريبه الثالثة له في المرضى الذين يعانون من سرطان البروستات المقاوم للخصي بعدما فشل العلاج الكيميائي معهم أثبتت النتائج نسبه بقاء على قيد الحياة لأكثر من 5 أشهر مقارنه بالعلاج الوهمي. وحاليا كل من (abiraterone) و(enzalutamide) يجري اختبارها في التجارب السريرية مع المرضى ذوي سرطان بروستات مقاوم للخصي الذين لم يتلقوا العلاج الكيميائي سابقا.الآن لوحظ أن مجموعة فرعية فقط من المرضى استجابو لأدوية تمنع الاشارات الخليويه الأندروجينية وخلايا معينة ذات خصائص تشبه الخلايا الجذعية لم تتأثر.
لذلك الرغبة في تحسين نتائج المرضى الذين يعانون من سرطان البروستات المقاوم للخصي أدت إلى المطالبة بجرعات إضافية أو زيادة الدمج بين العلاجات التي تعطي نتائج مضاعفة في النتيجة كدمج أدوية منع الإشارات الخليوية الاندروجينية. ولكن حتى هذه العلاجات المركبة أو المدمجة لا تؤثر على الخلايا-مثل-الجذعية، لأنه لا تظهر إشارات خليوية أندروجينية .
من الوسائل الممكن جدا أن تحرز المزيد من التقدم في العلاج بشكل مثالي أن يتم دمج عوامل مانعة للإشارات الخليوية الأندروجينية مع خلايا شبه جذعية موجهة للتمايز العلاجي .
العلاج الجراحي في إحدى الدراسات التي أُقيمت على رجال يعانون من سرطان البروستات غير المنتشر، وجد الأطباء أن مدة البقاء في المستشفى والحاجة إلى نقل الدم كانت أقل في هؤلاء الذين خضعوا للجراحة التنظيرية أو بالروبوت مقابل هؤلاء الذين خضعوا للجراحة التقليدية. بالرغم من هذا، ما زال من غير المعروف أي من هذه الطرق هي الأفضل في زيادة العمر وتقليل احتمال عودة المرض.
في سرطان البروستات، يمكن الاستعانة بهذه العملية الجراحية لعلاج العوارض كانسداد مجرى البول (الإحليل) الذي قد يسبب حصر البول. لا تقوم هذه الجراحة بعلاج السرطان بنفسه، إنما الانسداد فقط. تتم العملية عبر إدخال منظار المثانة عبر القضيب وقص البروستات لفتح مجرى البول.
مضاعفات العلاجالمضاعفات الأساسية لعلاج سرطان البروستات الجراحي أو الشعاعي هما ضعف الإنتصاب (عنانة)، و السلس البولي، خاصةً الإجهادي. أغلب الرجال يتحسنون خلال فترة 6 إلى 12 شهر، لذلك قد يؤجل الأطباء علاج هذه المشاكل إلى ما بعد السنة. العلاج الأولي يتضمن تمرين المثانة، تغييرات حياتية، تمارين كيجل، واستخدم الفوط الصحية. أما العلاج الجراحي فيتضمن استخدام المعلاق الإحليلي أو المصرة البولية الصناعية، وهو جهاز ميكانيكي يقوم بمحاكاة وظيفة العضلة المصرة للإحليل، حيث يتم تفعيل هذه العاصرة يدويا من قبل المريض عبر الضغط على زر يتم زراعته في الصفن. تعتبر هذه المصرة الاصطناعية العلاج الأفضل للسلس البولي المتوسط والحاد في الرجال الذين خضعوا لجراحة البروستات.ضعف الانتصاب أو العنانة قد يحصل بدرجات مختلفة في أغلب الرجال الذين يخضعون لجراحة البروستات أو العلاج الشعاعي للبروستات. بالرغم من ذلك، يتحسن الانتصاب خلال سنة في أغلب الرجال، إلا في حال حصول ضرر دائم في أعصاب الحوض. تتضمن العلاجات الدوائية مثبطات ال PDE-5 مثل الفياجرا أو السياليس، أو الأدوية التي تحقن مباشرةً في القضيب (البروستاجلاندين E1، أو الأدوية التي تعمل على الأوعية الدموية). العلاجات الإخرى تتضمن دعّامات القضيب (بدلة قضيبية) التي تزرع جراحياً، أو الأجهزة الفراغية.
نظام التصنيف
سرطان البروستاتا في كثير من أنواعه لا يعدّ قاتلا بحد ذاته، وغالبا ما يموت العديد من المصابين به نتيجة أسباب أخرى وليس نتيجة المرض ذاته. قرارات العلاج والوقت المحدد تحدد بناء على تقدير مخاطر الورم بعد العلاج ومدى قابليته للانتشار وتسببه بالوفاة.
تساعد عدة عوامل في توقع نتائج المرض مثل مراحل المرض وتكراره بعد الجراحة أو العلاج الإشعاعي. وبالإضافة لذلك، فإن الرتب ومستوى المولد المضاد الخاص (PSA)، وبإضافة عدد أو نسب إيجابية من العينات، والعمر وبعض المعلومات الأخرى، كلها تساعد في سرعة تقدير نتائج المرض.
-تصنيف أميكو (D'Amico) يقسم على أساس انخفاض، توسط، أو ارتفاع المخاطر، معتمد على المرحلة، الرتبة ومستوى (PSA). يستخدم هذا التصنيف بتوسع في العمل السريري وإعدادات البحوث. الجانب السلبي الرئيسي في نظام المستوى الثالث 3-level) system) أنه لا يُأخذ في الحسبان القياسات المتعددة السلبية مثل :ارتفاع مستوى الغيلسون ومستوى (PSA) (e.g., high Gleason score and high PSA) في المرضى المقسمين.
-جداول بارتين Partin tables : تنبأ بالنتائج المرضية (الهوامش، تمدد المرض خارج البروستات والتأثير على الحويصلات المنوية) يعتمد على نفس المتغيرات الثلاثة وجداول البحث.
-مخططات قطان Kattan nomogramS :تنبأ بتكرار المرض بعد إجراء الجراحة و/أو العلاج الإشعاعي، يعتمد على البيانات المتاحة سواء أثناء التشخيص أو بعد العلاج. هذه المخططات قادرة على الحساب باستخدام أوراق الرسوم البيانية المتاحة أو مواقع الإنترنت أو أجهزة الكمبيوتر المحمولة.
-نتيجة جامعتي كالفورنيا وسان فرانسيسكو لتقدير مخاطر سرطان البروستات (CAPRA): تقدّر كلا الحالة المرضية والتكرار بعد الجراحة، وتوفر مقارنة دقيقة قبل إجراء الجراحة كما هو موجود في مخططات قطان. تستطيع الحساب بدون استخدام الحاسبة أو جداول الورق. يتم تعيين النقطة اعتمادا على PSA ، الرتبة، المرحلة، العمر ونسبة العينات الإيجابية; مجموع نقاط من 0-10 مع كل نقطتين تمثل مضاعفة خطر تكرار المرض.
نقاط كابرا CAPRA score: المشتقة من قاعدة البيانات المجتمعية من قاعدة بيانات CaPSURE، وقد تم التحقق منها على مستوى 10.000 مريض مستأصل للبروستات، تتضمن مرضى من CaPSURE;تسجيل البحث تم من إدارة المحاربين القدامى والعديد من المراكز الطبية العسكرية; النشطة ولفيف متعدد من المؤسسات في ألمانيا; ومجموعة من المستأصلين للبروستات في جامعة جون هوكنز.في الآونة الأخيرة قدرت العديد من الوفيات وانتشار المرض بعد استئصال البروستات والعلاج الإشعاعي ، الانتظار اليقظ والعلاج المعتمد على الحرمان من الاندروجين.
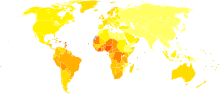
الأعمار المحددة للمتوفين من سرطان البروستات لكل 100.000 نسمة في 2004.
لاتوجد بيانات
أقل من 4
4-8
8-12
12-16
16-20
20-24
24-28
28-32
32-36
36-40
40-44
أكثر من 44
اعتباراً من عام 2011 اُعتبر سرطان البروستاتا ثاني أكثر أنواع السرطان شيوعاً، وشخص بأنه السبب السادس للوفاة بالسرطان عند الذكور في جميع أنحاء العالم. معدلات انتشار سرطان البروستاتا تختلف على نطاق واسع في جميع أنحاء العالم فهو أقل شيوعاً في جنوب وشرق آسيا، وأكثر شيوعاً في أوروبا والولايات المتحدة. وفقا لإحصائيات جمعية السرطان الأمريكية، سرطان البروستاتا يكون أقل شيوعاً بين الرجال الآسيويين، ويكون أكثر شيوعاً بين الرجال السود، بينما بين الرجال البيض يكون في وكان متوسط معدل الإصابة السنوية بسرطان البروستاتا بين عامين 1988 و 1992 بين الرجال الصينيين الذين يعيشون في الولايات المتحدة أعلى 15 مرة من نظرائهم الذين يعيشون في شانغهاي وتيانجين. ومع ذلك قد تتأثر هذه المعدلات المرتفعة من خلال زيادة معدلات الكشف. وتشير إلى إن معدلات سرطان البروستاتا قد تكون قيد المبلغ عنها، وبعد حدوث BPH أصبحت المعدلات في الصين واليابان تشبه المعدلات في الدول الغربية سرطان البروستاتا لدى الرجال تطور بأكثر من خمسين بالمئة. وفي عام 2008 في الولايات المتحدة كان هناك 186000 حالة مصابة بالسرطان ووفاة 28600 شخص بسبب هذا المرض. وهو السبب الرئيسي الثاني لوفيات السرطان في الرجال بعد سرطان الرئة، حيث يتم تشخيص حوالي 35000 حالة كل عام 10000 منها تموت بسببه، وقد تسببت عدة عوامل منها علم الوراثة والنظام الغذائي في تطور سرطان البروستاتا، وسرطان البروستاتا يمكن منعه بطريقة ابتدائية باستخدام (فينا ستريد) حيث يقلل من حدوثه بنسبة 30٪ ، وكان هناك أيضاً جدل حول هذا حيث أنه يزيد من خطر الإصابة بالسرطان، إلا أن الأبحاث الأخيرة أظهرت عكس ذلك. أكثر من 80 ٪ من الرجال المصابين بهذا النوع من السرطان كانوا في سن الثمانين. ومع ذلك في معظم الحالات يكون بطئ النمو، وتشخيص سرطان البروستاتا ( over diagnosis) والعلاج في مثل هؤلاء الرجال يعرضهم لمجموعه من الآثار الضارة، مع عدم وجود إمكانية لتمديد حياتهم.وعلى الرغم من الوصف الأول للبروستاتا الذي كان بواسطة ( Venetian anatomist Niccolò ) في عام 1536 ، ويتضح أيضاً من تشريح ( Flemish anatomist Andreas ) في عام 1538، سرطان البروستاتا لم يعرف هويته حتى عام 1538، واعتبر سرطان البروستاتا مرض نادر، وعلى الأرجح كان ذلك بسبب قصر حياة المصابين به ولأن أساليب الكشف عنه كانت قليلة جداً في القرن التاسع عشر، كانت العلاجات الأولى لسرطان البروستاتا عملية جراحية لتخفيف انسداد المسالك البولية. وكانت أول إزالة للغدة بالكامل بواسطة (radical perinealprostatectomy) في عام 1904 من قبل ( H Hugh Young ) في مستشفى (Johns Hopkins Hospital) . كان أول استئصال جراحي للخصيتين ( استئصال الخصية ) لعلاج سرطان البروستاتا في عام 1890s، ولكن مع نجاح محدود. استبدال استئصال البروستاتا عبر الإحليل من (TURP) و استئصال البروستاتا كان لتخفيف أعراض الانسداد في منتصف القرن العشرين لأنه يمكن الحفاظ على وظيفة انتصاب القضيب بشكل أفضل. وقد كان استئصال البروستاتا الجذري خلف العانة عام 1983 بواسطة ( Patrick Walsh) . ،
واستخدموا في هذا شبكات اتصال لاستئصال البروستاتا والغدد اللمفاوية مع الحفاظ على وظيفة القضيب.
في عام 1941 ( Charles B. Huggins ) نشر دراسات عن هرمون الاستروجين التي استخدمها لمعارضة إنتاج هرمون تستوستيرون لدى الرجال المصابين بسرطان البروستاتا النقيلي. فاز هذا الاكتشاف بجائزة نوبل عام 1966 في الفسيولوجيا أو الطب. وتم تحديد دور هرمون موجه للغدد التناسلية لإفراز (GnRH ) في الإنجاب عن طريق أندريه. شالي وروجر جيومان ( Schally and Roger Guillemi) اللذين فازا عام 1977 بجائزة نوبل في الفسيولوجيا أو الطب. وقد وضعت في وقت لاحق مستقبلات (GnRH) مثل يوبروليد وجوسيريلين (leuprolide and goserelin) وتستخدم لعلاج سرطان البروستاتا. كان أول من طور العلاج الإشعاعي لسرطان البروستاتا في أوائل القرن العشرين وتألف في البداية من زرع الراديوم داخل البروستاتا، وأصبح العلاج بالإشعاع الخارجي أكثر شعبية وأقوى ( الأشعة السينية ) أصبحت متاحة في منتصف القرن العشرين. وكان أول وصف للعلاج الإشعاعي الموضعي مع البذور المزروعة لسرطان البروستاتا في عام 1983. كان أول درس للعلاج الكيميائي النظامي لسرطان البروستاتا في عام 1970. وسرعان ما انضم الأولي لنظام ( cyclophosphamide and 5-fluorouracil) على عدة نظم متعددة باستخدام مجموعة أخرى من أدوية العلاج الكيميائي النظامية.
خلية من خلايا المنشأنشرت مجلة science سلسلة من الدراسات شملت فيروسات يعرف بأنها مسببة لتحولات سرطانية في خلايا البروستاتا، حيث حُولت AKT و ERG و AR إلى عينات معزولة من الخلايا اللمعية والقاعدية، وزرعت الانسجة المعالجة في الفئران، وبعد 16 اسبوعا، لم تخضع أيا من العينات اللمعية على تحولات خبيثة، في حين تحولت العينات القاعدية إلى أنابيب تشبه البروستاتا، والتي تطورت بعد ذلك إلى خلايا خبيثة وشكلت أوراما سرطانية، والتي ظهرت مطابقة للعينات البشرية تحت التكبير، وهذا يقودنا إلى نهاية مفادها أن خلايا البروستاتا القاعدية قد تكون موقع المنشأ لسرطان البروستاتا.يصادف المصابين بسرطان البروستاتا بشكل عام فروقات مهمة في التعريف، والتمويل، والتغطية الإعلامية، انتشار البحث، ولذلك يحصلون على معاملة أدنى ونتائج أقل جودة، مقارنة بسرطانات أخرى تعادلها "ذا غارديان" أن نشرت 2001 بأن 3000 ممرضة في بريطانيا تخصصت في مجال سرطان الثدي مقابل شخص واحد في سرطان البروستاتا، كما كشفت أن وقت الانتظار بين الإحالة والتشخيص بالنسبة لسرطان الثدي إسبوعين فقط، في حين يصل إلى ثلاثة أشهر بالنسبة لسرطان البروستاتا .
وفي تقرير أصدرته الولايات المتحدة متمثلة في الإتلاف الوطني لسرطان البروستاتا تقريرا ذكر أن كل عقار في السوق لعلاج سرطان البروستاتا يقابله سبعة عقارات لعلاج سرطان الثدي، كما أشارت "ذا تايمز" إلى
وجود تحيز ضد الذكور في تمويل السرطان، مع تناقض إلى أربعة تناقضات في المملكة المتحدة من قبل جمعيات السرطان الخيرية أيضا ك "كانسر ريسيرش يو كي" وحكال وبنفس المعدل تحدث عدد من النشطاء كالمؤلف وارن فارل عن إنفاق غير متساوٍ ليكون مثالا واضحا عن تفضيل الحكومة غير العادل لصحة الإناث على صحة الذكور.وتمتد التفرقة لتشمل مناطق أخرى كالكشف، مع فشل الحكومة في تمويل أو التكلف بفحص سرطان البروستاتا لفحص سرطان البروستاتا في حين هناك دعم كامل لبرامج سرطان الثدي. ففي عام 2007 مثلا وجد تقرير أن ولاية فقط لسرطان 28 ولاية أمريكية غطّت التأمين للفحص الروتيني لسرطان الثدي، في مقابل 49 البروستاتا.كما أن سرطان البروستاتا حصل على تغطية إعلامية أقل بكثير مقارنة بالسرطانات الأخرى تساويها في الانتشار، وقد أظهرت دراسة للإتلاف البروستاتا أن مقابل 2,6 قصة لسرطان الثدي هناك قصة واحدة فقط لسرطان البروستاتا.تحدث التوعية بسرطان البروستاتا في شهر سبتمبر في عدد من الدول، ويستخدم شريط ذا لون أزرق فاتح لتعزيز القضية.
بحث
العلاجحصل دواء Enzalutamide على موافقة هيئة الغذاء والدواء الأمريكية لعلاج سرطان البروستاتا المقاوم للإخصاء في عام 2012 كما يستخدم دواء Alpharadin لعلاج مرضى سرطان البروستاتا المقاوم للإخصاء الذين انتشر لديهم السرطان للعظام. وأظهرت التحاليل تحسن في مدة البقاء على قيد الحياة وفي نوعية الحياة، وأوقفت الدراسات لاحقا لاسباب أخلاقية؛ حيث أعطي المرضى الوهميين نفس العلاج. يستخدم Alpharadinعنصر الراديوم الذي يستهدف العظم ويقتل الخلايا السرطانية بواسطة إشعاع ألفا. وقد وافقت عليه هيئة إدارة الغذاء والدواء الأمريكية في شهر مايو 2013 ولكنه ما زال تحت الرقابة. بينما لم توافق عليه بعد الوكالة الأوروبية للأدوية. انزيم أركيدونات 5-أكسيجيناز شحمية له دور كبير في بقاء الخلايا السرطانية على قيد الحياة. الأدوية والعقاقير التي تستهدف هذا الإنزيم قد يكون لها تأثير فعال في الحد من نمو الورم وانتشاره وكذلك تحفيز عملية الموت المبرمج للخلية في الخلايا السرطانية. وعلى وجه الخصوص، فإن مثبطات هذا الإنزيم تحفز الموت المبرمج السريع للخلايا السرطانية.
نماذج سرطان البروستاتاقام العلماء بزرع الخلايا السرطانية وتنمية عدد من منها لمعرفة آلية تطور سرطان البروستاتا. و خلايا سرطان البروستاتا LNCAP، PC3 ،DU-145 هي المستخدمة عادة لدارستها. خلايا LNCAP تؤخذ من القعد اليمفاوية التي انتشر إليها السرطان بينما PC3 و DU-145 تؤخذ من سرطان البروستاتا المنتشر لكل من العظم والدماغ على الترتيب. لها السرطان، أما خلايا LNCAP و تحوي التعبير الجيني لمستقبلات الأندروجين (AR) (هرمون تنشيط الذكورة )، بينما خلايا PC3 و DU145 لديها تعبير جيني قليل أو معدوم لهذه المستقبلات(AR) و لكنها عوامل نسخ وهي من عائلة المستقبلات الستيرويدية النووية. وتطور سرطان البروستاتا يعتمد على إشارات الأندروجين المنتقلة بواسطة مستقبلات الأندروجين لذلك فإن مستقبلات الأندروجين مهمة في تطور سرطان البروستاتا. تكاثر خلايا LNCAP لا يتأثر بالاندروجين بينما تطور خلايا DU-145 وPC3 ونموها يعتمد على الاندروجين. زيادة التعبير الجيني لمستقبلات الاندروجين يلاحظ غالبا لدى مرضى سرطان البروستاتا المتقدم. بعض خلايا LNCAP الغير معتمدة على الأندروجين تطورت من خلايا تعتمد على الأندروجين بعد إزالة الأندروجين لدراسة تطور سرطان البروستاتا. وهذه الخلايا الغير معتمدة على الأندروجين يزيد فيها مستقبلات الأندروجين والأنتيجين الخاص بالبروستاتا بعد العلاج بالأندروجين. الأندروجين يثبط نمو وتكاثر خلايا سرطان البروستاتا الغير معتمدة على الأندروجين.
التشخيصفي الوقت الحالي تجري العديد من الأبحاث والتحقيقات غير السريرية التي تتضمن طرق غير مؤذية للكشف عن سرطان ليصيب خلايا الورم السرطاني بجيناته غير المؤذية البروستاتا. يعدل العلماء نوع من الفيروسات Adenovirusis وهذه الطريقة أثبتت فعاليتها في التشخيص المبكرعن طريق نقل انواع محددة من الجينات مثل (luciferase)، ومع ذلك حتى الآن هذه البحوث تم اختبارها على الحيوانات وعينات خلايا LNCAP.
EN2وجود هذا الجين في البول يرتبط باحتمالية كبيرة للإصابة بسرطان البروستاتا.
PCA3طريقة أخرى للكشف المبكر عن سرطان البروستاتا من خلال الاختبار الجزيئي الذي يكشف وجود (PCA3 mRNA) في الخلايا الموجودة في السائل المأخوذ من البروستاتا والذي يدمج مع كمية قليلة من البول في وعاء يحوي العينة. PCA3 mRNA تتواجد طبيعيا بكميات كبيرة في غدة البروستاتا وتزداد بشكل كبير في خلايا سرطان البروستاتا. نتيجة الاختبار تسجل كنسبة PCA3 mRNA إلى نسبة mRNA PSA. وبالرغم من أنه لا يحل محل اختبار مستوى PSA في الدم إلا انه يساعد على معرفة ما إذا كان من المتوقع حدوث سرطان البروستاتا. وكلما زادت نسبة في العينة زادت احتمالية الإصابة بالسرطان.
أنتيجين سرطان البروستاتا المبكرAPCA-2هناك اختبار جديد لمستوى هذا الأنتيجين في الدم، يمكن أن يدل الرجال ما إذا كانوا مصابين بسرطان البروستاتا ومدى تقدم المرض لديهم. التهاب الوريد الخثاري يصاحبه زيادة خطر الإصابة بسرطان البروستاتا وقد يكون طريقة جيدة ليتذكر الأطباء أن يفحصوا مرضى التهاب الوريد الخثاري للكشف عن سرطان البروستاتا، لأن هذين المرضين مرتبطان ببعضهما.
البروستاسومزالبروستاسومز هي عضيات محاطة بغشاء من (PSA)و(Prostasomes ) الخلايا الطلائية في غدة البروستاتا تفرز البروستاتا وتكون خارج الخلايا، وإحدى وظائفها الفسيولوجية توفير حماية للحيوانات المنوية من مهاجمة الجهاز المناعي.
انظر أيضًا
اجتثاث الحوض
سرطان الخلايا الصغيرة
جورج ويلدينج
كروموبليكسي
1 الأعراض
2 الأسباب
2.1 الجينات
2.2 التغذية
2.3 التعرض للعلاجات
2.4 العدوى الفيروسية
2.5 العوامل الجنسية
3 الميكانيكية (الآلية) المرضية
4 التشخيص
4.1 تصوير البروستات
4.2 الخزعة
4.3 مقياس (نقاط) جليسون
4.4 علامات الأورام
4.5 التصنيف
5 الوقاية
5.1 النظام الغذائي
5.2 الأدوية
6 الفحوصات
7 علاج سرطان البروستات
7.1 المراقبة الفاعلة
7.2 العلاج
7.2.1 العلاج غير الجراحي
7.2.2 العلاج الجراحي
7.3 مضاعفات العلاج
8 نظام التصنيف
8.1 خلية من خلايا المنشأ
9 بحث
9.1 العلاج
9.2 نماذج سرطان البروستاتا
9.3 التشخيص
9.3.1 EN2
9.3.2 PCA3
9.3.3 أنتيجين سرطان البروستاتا المبكرAPCA-2
9.3.4 البروستاسومز
10 انظر أيضًا
11 معرض صور
12 المراجع
13 وصلات خارجية
معرض صور